Présentation de la maladie
En résumé
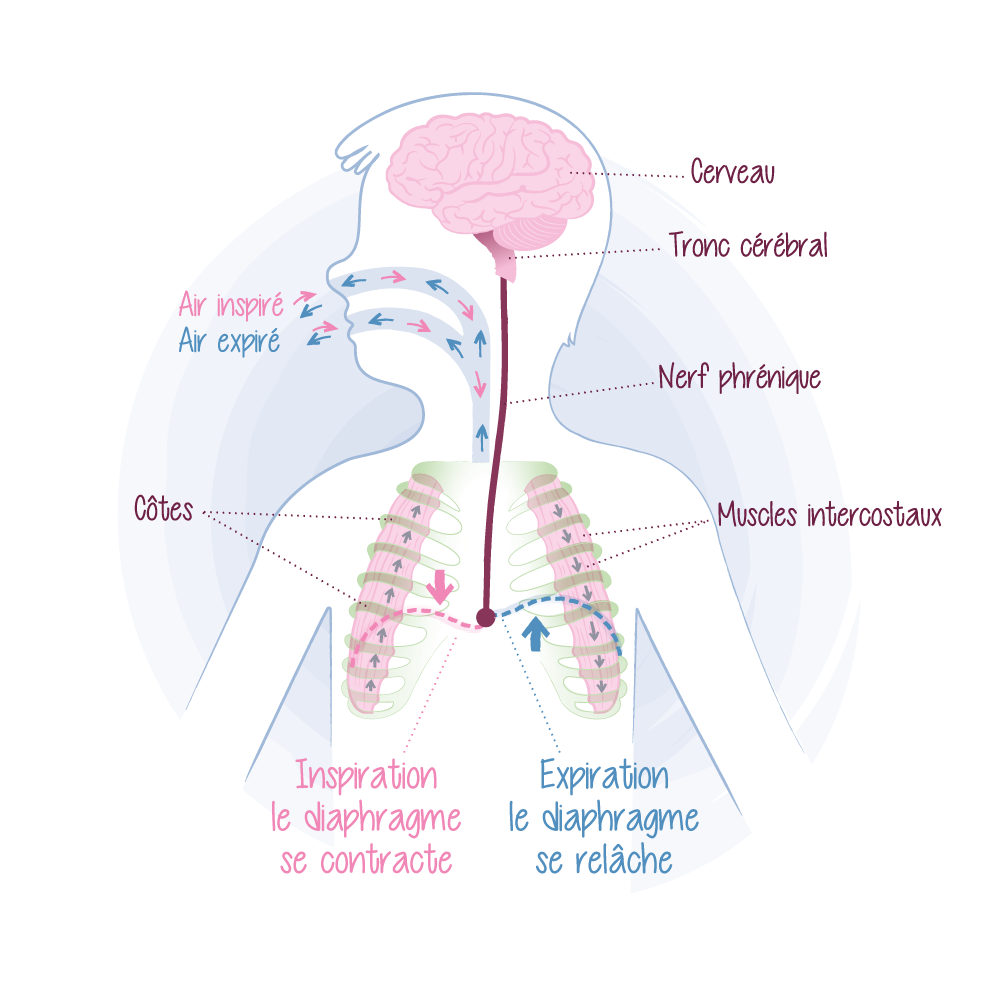
La respiration présente la propriété singulière de pouvoir être réalisée de manière automatique ou volontaire : par exemple, nous pouvons décider de prendre une grande inspiration, retenir notre souffle pour nager sous l’eau ou éviter une mauvaise odeur. A l’inverse, la plupart du temps nous respirons sans y penser, et c’est d’ailleurs ce qui se passe pendant le sommeil. La respiration s’effectue de façon automatique, en fonction de l’évolution des taux sanguins de dioxyde de carbone et d’oxygène. Cela est contrôlé par le système nerveux autonome qui gère les processus physiologiques inconscients.
Dans le syndrome d’Ondine (encore appelé syndrome d’hypoventilation centrale congénitale), les patients présentent un dysfonctionnement central du contrôle nerveux autonome responsable de la respiration automatique. Cela se traduit notamment par leur incapacité à respirer de façon autonome notamment durant les périodes de sommeil, nécessitant une assistance ventilatoire qui leur est vitale. Nommée en référence à la nymphe d’Ondine de la mythologie grecque, le syndrome d’Ondine est une maladie génétique rare dont l’incidence est de 1 pour 200 000 naissances vivantes en France et la prévalence estimée à 1/550 000. Dans 90 % des cas, une anomalie du gène PHOX-2B est en cause.
Personnes concernées
Dans la grande majorité des cas, cette maladie congénitale se révèle dès la naissance. Plus rarement, le syndrome d’Ondine peut se révéler dans la petite enfance, à l’adolescence, voire à l’âge adulte. Des formes familiales existent aussi. Le syndrome d’Ondine touche autant les garçons que les filles.
Causes
L’origine génétique du syndrome d’Ondine a été établie en 2003 suite à la découverte d’une mutation sur le gène PHOX2B. La maladie se transmet selon un mode autosomique dominant : si un des deux parents est porteur du gène défectueux, le risque d’avoir un enfant malade est de 50 % à chaque grossesse.
Symptômes
Le diagnostic du syndrome d’Ondine est généralement suspecté chez le nouveau-né, dès ses premiers jours de vie. C’est la persistance des difficultés respiratoires entrainant une hypoventilation alvéolaire sévère et la nécessité d’une assistance ventilatoire mécanique inexpliquée (c’est-à-dire sans cause cardiaque, neurologique ou musculaire) qui fait penser au diagnostic.
Le syndrome d’Ondine peut être associé à la maladie de Hirschsprung, qui cause des troubles digestifs (occlusion intestinale, constipation) et à d’autres symptômes dus à l’atteinte du système nerveux autonome tels que des troubles oculaires, cardiovasculaires (pouvant notamment nécessiter la mise en place d’un stimulateur cardiaque), hormonaux et comportementaux. Plus rarement, une tumeur des cellules de la crête neurale peut se développer (exemple : neuroblastome).
Conseil génétique
Un conseil génétique est nécessaire dès l’annonce du diagnostic. L’analyse génétique des parents est systématique. Dans la majorité des cas, la mutation sur le gène PHOX2B est de novo (nouveau) chez les patients. Cependant, il à noter que 10 % des mosaïques (gènes discontinus) sont retrouvés chez les parents.
Il est recommandé chez le patient atteint du syndrome d’Ondine porteur de la mutation (sur le gène PHOX2B), de bénéficier d’un conseil génétique au moment du projet de grossesse ; dans le but de connaître toutes les possibilités de prise en charge utiles (diagnostic prénatal).
Prise en charge
La prise en charge du syndrome d’Ondine implique un suivi global et multidisciplinaire : elle est en effet, organisée de façon à favoriser le maintien du patient au domicile et sa mobilité dans la vie de tous les jours. Pour cela, une coordination rigoureuse est menée entre la famille, les praticiens de ville, les équipes hospitalière, le centre de référence ou de compétence, ainsi que les lieux de vie habituelles (crèche, école, lieu de travail).
Une assistance ventilatoire est vitale et requise à tout âge et à vie : un ventilateur mécanique est mis en place jour et nuit dès la naissance souvent par trachéotomie. Chez les enfants plus âgés et chez l’adulte, il est possible d’avoir recours à une assistance non invasive : un masque à garder en période de sommeil et dans toutes les situations où la vigilance est réduite (par exemple : fatigue, somnolence après repas, stress, perte de connaissance quelle qu’en soit la cause, etc.).
L’implantation d’un stimulateur phrénique peut s’avérer nécessaire dans de rares cas. Il est indispensable d’avoir toujours et partout un dispositif d’assistance ventilatoire, que ce soit sur le lieu de scolarité, d’étude ou de travail, à domicile ou en voyage. Des contrôles réguliers des paramètres physiologiques respiratoires durant le sommeil sont indispensables pour adapter les constantes de l’appareil de ventilation au cours de la croissance de l’enfant4, ainsi qu’au cours de la vie de l’adulte ; en plus d’un suivi médical régulier afin de prévenir et traiter les troubles non ventilatoires : ophtalmologique, cardio-vasculaire, ORL, digestif et neuropsychologique.
Relecture par Pr Christian STRAUS, chef de service d’explorations fonctionnelles de la respiration, de l’exercice et de la dyspnée, responsable du centre de référence constitutif des maladies pulmonaires rares (OrphaLung), hôpital universitaire Pitié-Salpêtrière AP-HP, Paris ; Pr Ha TRANG, centre pédiatrique du sommeil, centre de référence constitutif des maladies respiratoires rares (RespiRare), hôpital universitaire Robert Debré AP-HP, Paris. – mise à jour janvier 2020
1. Centre de référence des Maladies Respiratoires Rares de l’Enfant et de l’Adulte, PNDS syndrome d’Ondine, Février 2018. 2. Amiel J, Laudier B, Attié-Bitach T, Trang H, et al. 2003. Polyalanine expansion and frameshift mutations of the paired-like homeobox gene PHOX2B in congenital central hypoventilation syndrome. Nat Genet ;33(4):459-61. 3. Le terme « hypoventilation » désigne une « diminution du volume d’air inspiré ». Elle entraine une entrée insuffisante d’oxygène par les poumons et une élimination insuffisante de dioxyde de carbone. 4. Trang H, Dehan M, Beaufils F, et al. The French congenital central hypoventilation syndrome registry: general data, phenotype, genotype. Chest. 2005;127:72-9.

