Organisé par l’Association de Pneumo-Pédiatres InterRégionale (ASPPIR), l’Association Immuno-Allergie Infantile (AIAI) et la Société Pédiatrique de Pneumologie (SP2A), le congrès de pneumologie et d’allergologie pédiatrique « CPAP » s’est tenu comme à son habitude à la Maison de la Chimie, Paris 5ème du 16 au 18 novembre 2023. Cet événement a rassemblé de nombreux professionnels venus de divers horizons, et fût l’occasion pour la filière d’accroitre la visibilité des maladies respiratoires rares auprès des pneumopédiatres par la tenue d’un stand dédié.


Plusieurs outils sous forme de dépliants et livrets étaient mis à leur disposition, notamment :
- La plaquette des réunions de concertation pluridisciplinaire (RCP) RespiFIL ;
- Le kit transition enfant-adulte Ready Steady Go et l’enquête en ligne pour recenser les avis, les retours d’expériences et les réels besoins des patients atteints de maladies respiratoires rares et des professionnels de santé concernés par la transition enfant-adulte ;
- Les livrets d’information « maladies » à destinations des patients ;
- La plaquette « les clés du diagnostic » permettant d’entreprendre pour un médecin généraliste ou un pédiatre, une procédure diagnostique en ligne ;
- Le livret sur le séquençage du génome ;
- Les cartes d’urgence dont l’objectif est l’amélioration de la coordination des soins des patients atteints de maladies respiratoires rares en situation d’urgence.
De nombreux experts du centre de référence des maladies respiratoires rares – RespiRare étaient au rendez-vous et ont pu présenter leurs travaux. Vous trouverez dans cet article un résumé de certaines communications dédiées aux maladies respiratoires rares.
L’actualité en pneumologie a fait place au nouveau PNDS dysplasie bronchopulmonaire, qui a suscité un vif intérêt auprès des pneumopédiatres présents comme a pu le témoigner la salle comble.



L’objectif d’un PNDS est d’expliciter aux professionnels concernés la prise en charge diagnostique et thérapeutique optimale actuelle et le parcours de soins d’un patient atteint d’une maladie rare donnée. Il a pour but d’optimiser et d’harmoniser la prise en charge et le suivi de la maladie rare sur l’ensemble du territoire.
Sous la coordination du Dr Céline Delestrain (hôpital Intercommunal de Créteil, centre de référence constitutif des maladies respiratoires rares – RespiRare) et le Pr Alice Hadchouel-Duvergé (hôpital Necker-Enfants Malades, AP-HP, centre de référence coordonnateur des maladies respiratoires rares – RespiRare), le PNDS DBP a été élaboré par un groupe de travail multidisciplinaire (pneumopédiatres, cardiopédiatres, néonatologistes, gastropédiatres, médecins généralistes, pédiatres de ville, psychomotricienne et associations de patients), représentatif de l’ensemble du territoire national, intervenant à différentes étapes de la prise en charge des patients atteints de la DBP. Il est accessible sur le site de la HAS et de RespiFIL depuis août 2023.
La DBP est une maladie respiratoire rare qui se manifeste principalement chez des enfants nés extrêmes ou grands prématurés, avant 32 semaines d’aménorrhée (SA). Elle est caractérisée par un défaut du développement alvéolo-capillaire, entraînant une insuffisance respiratoire chronique (IRC). Le diagnostic effectué par le pédiatre néonatal, repose sur l’évaluation de la nécessité d’une oxygénothérapie et/ou d’un support ventilatoire à 36 semaines d’âge post-menstruel (APM).
La prévention optimale de la DBP est d’éviter la naissance prématurée. Lorsque celle-ci ne peut pas être évitée, une vigilance doit être portée sur les événements maternels et postnatals pour minimiser le risque de développer la DBP. Après 4 semaines de vie, l’objectif est de restreindre l’évolution vers une DBP modérée à sévère à 36 semaines d’APM.
Quelle est la prise en charge avant le retour à domicile ?
La prise en charge est multidisciplinaire. Au niveau nutritionnel, il essentiel d’adapter les apports à la dépense énergétique pour permettre une croissance pulmonaire (120 à 150 kcal/kg/jour), et de traiter éventuellement le reflux gastro-œsophagien (RGO) au cas par cas. La prévention des infections respiratoires est cruciale, impliquant l’évitement de la crèche collective la première année, une forte recommandation pour la vaccination antigrippale à partir de six mois, et l’immunoprophylaxie par un anticorps monoclonal anti-VRS. Sur le plan social, une prise en charge particulière est nécessaire en cas d’arrêt prolongé d’un des deux parents.
Sur le plan respiratoire, les modalités de prescription et de suivi d’une oxygénothérapie de longue durée (OLD) s’appuient sur les recommandations du Groupe de Recherche sur les Avancées en Pneumologie Pédiatrique (GRAPP) de l’hypoxémie chronique chez le nourrisson à terme. Les critères incluent une SpO2 moyenne inférieure à 93 % au sommeil ou à l’éveil et/ou supérieure à 5 % du temps inférieure à 90 %, et/ou une hypertension artérielle pulmonaire (HTAP). En l’absence d’HTAP, l’OLD doit permettre de maintenir une SpO2 moyenne > 92 % quelle que soit l’activité de l’enfant. Lorsque l’HTAP est associée à la DBP, l’objectif de la SpO2 est toujours > 94 % que ce soit à l’éveil ou pendant au moins 95 % du temps au sommeil. Ainsi, avant la sortie, une oxymétrie nocturne, des mesures ponctuelles à l’éveil et une échocardiographie sont essentielles pour confirmer la nécessité de l’OLD et dépister une hypertension pulmonaire.
En ce qui concerne les traitements médicamenteux, les diurétiques administrés en période néonatale peuvent être maintenus, et le sevrage se fera naturellement avec la croissance pondérale de l’enfant sous OLD. En cas de signes d’hyperactivité bronchique persistants, un traitement inhalé par bronchodilatateurs de courte durée d’action associé à un corticoïde inhalé peut être envisagé au cas par cas.
Situations particulières
Dans les situations particulières où un nourrisson nécessite un support ventilatoire à 37 semaines d’âge post-menstruel (APM), la démarche diagnostique comprend :
- Si HTP ou capnie élevée, il est nécessaire d’optimiser la ventilation et l’oxygénation.
- Le RGO est une comorbidité fréquente dont la prise en charge repose essentiellement sur l’épaississement du lait éventuellement couplé à la prescription d’un traitement par inhibiteurs de la pompe à protons (IPP) après la réalisation d’une pH-métrie.
- Sur le plan ORL, l’existence d’une dysphonie ou d’un bruit respiratoire autre qu’un wheezing expiratoire (stridor inspiratoire, cornage aux 2 temps) ou l’existence d’une toux rauque doivent motiver la réalisation d’une nasofibroscopie au moindre doute.
- Diagnostic différentiel : la réalisation d’un scanner thoracique injecté permettra de rechercher une autre pathologie parenchymateuse pulmonaire comme une pneumopathie interstitielle, une bronchopathie, une anomalie des arcs aortiques.
Pour construire un projet de soins cohérent, les autres complications de la prématurité doivent être évaluées et prises en compte. Il s’agit notamment des complications neurologiques (IRM cérébrale) et neurosensorielles (ORL, ophtalmologiques). Le contexte social et familial doit également être pris en considération pour déterminer le projet de soins.
Quelle est la fréquence du suivi ?
Le suivi pneumologique régulier est nécessaire chez le nourrisson et le jeune enfant, qui doit se poursuivre à plus long terme pour :
- Dépister les manifestations cliniques et les altérations fonctionnelles
- Favoriser l’adaptation à l’exercice
- Lutter contre le tabagisme passif puis actif qui ajouterait à la DBP un facteur de risque majeur de développer une BPCO à l’âge adulte.
- Éviter les expositions environnementales néfastes
La DBP peut avoir des conséquences à l’âge adulte, justifiant un suivi dans des structures médicales d’adultes. La transition enfant-adulte est gérée de manière coordonnée par le centre de référence des maladies respiratoires rares de l’enfant (RespiRare) et le centre de référence des maladies pulmonaires rares de l’adulte (OrphaLung). Cette collaboration assure une gestion optimale de la transition patient-enfant-adulte.
Dans cette session de mise au point sur les maladies rares, le Pr Nadia Nathan (hôpital Armand Trousseau AP-HP, centre de référence constitutif des maladies respiratoires rares – RespiRare) dévoile les nouveaux chiffres des PID de l’enfant en France. En effet, il ressort des études précédentes que la prévalence des PID chez les enfants varie de 0,3 à 83 cas/million d’habitants, touchant principalement les jeunes enfants (âge moyen de 1,5 ans) de manière équilibrée entre les sexes. Entre 5 et 20 % des PID se présentent sous des formes familiales, associées à une morbidité et une mortalité élevées (15 %).
Les données concernant les PID chez adultes sont distinctes avec une prévalence de 1000 cas/million d’habitants et l’incidence est de 200 cas/million d’habitants. L’âge médian au diagnostic est de 56 ans avec une prédominance masculine. Les formes familiales représentent 10 à 20 % des cas, associées à des facteurs de risque génétiques, environnementaux (expositions professionnelles), tabagisme et reflux gastro-œsophagien (RGO). La morbidité et la mortalité demeurent élevées, atteignant environ 50 % dans les trois ans suivant le diagnostic.
« Il était nécessaire de réaliser une étude épidémiologique des PID chez les enfants en France, en se basant sur des paramètres tels que la prévalence, l’incidence, et en prenant en compte les différentes causes de ces maladies, ainsi que l’âge auquel elles se manifestent », explique le Pr Nathan.
Les données ont été recueillies à partir des 42 centres de référence et de compétence des maladies respiratoires rares (RespiRare), combinant une analyse rétrospective couvrant la période de 2000 à 2022 et une prospective de février 2022 à 2023. La collecte s’est effectuée à partir de la base e-Respirare, de l’outil de gestion des réunions de concertation pluridisciplinaires (RCP) RespiFIL des PID pédiatriques, ainsi que directement auprès des centres hospitaliers et de la banque nationale des données maladies rares (BNDMR).



La prévalence et l’incidence des PID pédiatriques
L’étude a inclus 790 patients sur 22 ans, principalement des enfants âgés de moins de 2 ans. Parmi eux, 18 % étaient nés prématurés et 17 % avaient des antécédents familiaux de PID. L’âge médian au moment du diagnostic était de 3 mois, avec un ratio équilibré entre les sexes. Ainsi, en 2022, la prévalence des PID chez les enfants était de 44 cas pour un million d’habitants et l’incidence sur un an était de 4,4 cas pour un million d’habitants.
La démarche diagnostique
Les examens complémentaires systématiquement réalisés comprenaient le scanner thoracique (90,6 %), révélant principalement des lésions de type verre dépoli, l’échographie cardiaque (20 % des cas montrant une hypertension pulmonaire) et un bilan d’auto-immunité (95,6 %), positif dans 25,3 % des cas. La signature d’interféron a été réalisée dans 13 % des cas avec un résultat positif chez 36 % d’enfants. Environ 77 % des patients ont bénéficié d’une analyse génétique, aboutissant à des résultats positifs dans 41,8 % des cas (22 % concernant les maladies du surfactant pulmonaire). D’autres examens tels que la fibroscopie bronchique avec lavage broncho-alvéolaire (61,9 %) et, plus rarement, la biopsie pulmonaire (23,4 %), ont également été effectués.
Chez les enfants de moins de 2 ans, les causes les plus courantes étaient liées aux pathologies du surfactant (23,7 %), et à l’hyperplasie des cellules neuroendocrines du nourrisson (NEHI). Chez les enfants plus âgés (2 à 18 ans), les causes les plus fréquentes comprenaient les hémorragies alvéolaires et l’hémosidérose, les pathologies du tissu conjonctif (connectivites), les pneumopathies d’hypersensibilité, la sarcoïdose et les vascularites. Malheureusement, des PID restent non-étiquetées dans 30,1 %.
La prise en charge
Parmi les traitements, la corticothérapie prédomine (IV 50 %, per os 40,2 %), tandis que l’azythromycine, les immunosuppresseurs, l’hydroxycloroquine sont utilisées dans 27, 3%, 20,3 %, 15,7 % respectivement. L’oxygénothérapie et la nutrition entérale ont été préconisées respectivement chez 52 %, et 27 % des enfants atteints de PID. La transplantation pulmonaire pédiatrique reste très rare (1,7 %).
En conclusion, l’incidence et la prévalence présentées dans cette étude sont plus élevées que celles précédemment rapportées en raison de meilleurs outils diagnostiques (test génétique, RCP) et une meilleure exhaustivité des données. Cela ouvre de nouvelles perspectives pour des essais cliniques actuellement en cours notamment l’essai évaluant le nintédanib (un antifibrosant) dans les fibroses pulmonaires pédiatriques et le PHRC CORTICONEHI évaluant l’efficacité des bolus de corticoïdes dans le NEHI.
Dans cette session de mise au point sur les maladies rares, le Dr Jessica Taytard (hôpital Armand Trousseau AP-HP, centre de référence constitutif des maladies respiratoires rares – RespiRare) décrit les apnées centrales chez l’enfant. Se sont des interruptions temporaires de la respiration qui résultent d’un dysfonctionnement du système respiratoire central, situé dans le tronc cérébral. Contrairement aux apnées obstructives, où le flux d’air est bloqué en raison d’une obstruction des voies respiratoires, les apnées centrales surviennent lorsque le cerveau cesse temporairement de donner des signaux appropriés aux muscles respiratoires pour initier la respiration.
Les générateurs du rythme respiratoire central sont des groupes de neurones situés dans le tronc cérébral, et sont responsables de la régulation du rythme respiratoire en contrôlant l’activité des muscles respiratoires, notamment le diaphragme et les muscles intercostaux. Ils comprennent :
- le noyau respiratoire dorsal (NRD) : situé dans le bulbe rachidien, il est responsable de l’inspiration. Il envoie des signaux moteurs aux muscles inspiratoires, déclenchant ainsi l’expansion des poumons et l’entrée d’air.
- le noyau respiratoire ventral (NRV) : situé également dans le bulbe rachidien, il intervient principalement dans l’expiration. Il envoie des signaux moteurs aux muscles expiratoires pour permettre l’expiration de l’air des poumons.
- les centres pneumotaxiques et apnéustiques : situés dans le tronc cérébral, ils contribuent à la régulation fine du rythme respiratoire en ajustant la durée et la fréquence des cycles respiratoires.
Les seuils d’apnée se réfèrent aux niveaux critiques de PaO2 et PaCO2 qui déclenchent la reprise automatique de la respiration. En cas de baisse significative de la PaO2 ou d’augmentation importante de la PaCO2, les seuils d’apnées peuvent être déclenchés, entraînant une interruption temporaire de la respiration.
Les apnées centrales chez l’enfant ont été définies en polysomnographie (PSG) par l’American Academey of Sleep Medicine (AASM) :
- Absence de flux nasal en relation avec une absence d’efforts respiratoires (pas de mouvements thoraciques/abdominaux).
- Pendant plus de 20 secondes ou durant plus de 2 cycles respiratoires si l’évènement est associé à un micro-éveil, un réveil ou une désaturation de plus de 3 %.
L’index d’apnées centrales (IAC) mesure le nombre d’apnées centrales par heure pendant le sommeil. Un IAC supérieur à 5 par heure est généralement considéré comme pathologique pour les enfants d’une manière générale, à l’exception des nourrissons ou des études sont encore nécessaires pour définir ce seuil. La prévalence du syndrome d’apnées centrales du sommeil varie de 3 à 5,4 % parmi les enfants (sains ou non) ayant bénéficié d’une PSG. La classification est généralement basée sur le mécanisme physiopathologique (classification ancienne), ou selon la pathologie sous-jacente (classification plus récente) (voir capture-ci-dessous).

La démarche diagnostique et la prise en charge
La présentation clinique du syndrome des apnées centrales du sommeil est assez variable et aspécifique. La PSG (nuit complète à l’hôpital) doit être réalisée à la moindre suspicion en présence de facteurs de risque du syndrome des apnées centrales. Ainsi, un bilan approfondi doit être effectué pour déterminer la cause sous-jacente, notamment des analyses génétiques, avec une priorité pour le gène PHOX2B ou une analyse du génome entier si l’indication est retenue en RCP nationale IRC et anomalies du contrôle ventilatoire. Ce bilan inclut également une IRM cérébrale et médullaire, un électroencéphalogramme, des bilans endocrinien (thyroïdien), cardiologique, ORL et une pH-métrie (RGO). Il est également suggéré de réaliser des explorations du contrôle ventilatoire telles que le test de réponse au CO2 ou la mesure du loop gain, évaluant l’intensité de la réponse de la commande ventilatoire aux variations de la PaCO2 et de la PaO2.
La prise en charge peut inclure la ventilation non-invasive, l’oxygénothérapie, des traitements médicamenteux (caféine, acétazolamide), ou le traitement de la pathologie sous-jacente identifiée.



Chez l’enfant, environ 250 allogreffe de cellules souches hématopoïétiques (ACSH) sont effectuées par an en France. L’amélioration de leur prise en charge a permis une augmentation de leur espérance de vie mais parallèlement l’apparition de complications tardives. Les complications pulmonaires tardives non infectieuses (CPTNI) post ACSH aggravent la morbidité et la mortalité chez l’enfant. Ces complications sont hétérogènes et les rares études pédiatriques ne permettent pas d’obtenir une description précise de ces pathologies. L’apparition des CPTNI reste très mal comprise, mais elles sont souvent assimilées à une réaction immunologique du greffon contre l’hôte (GVH).
Le Pr Véronique Houdouin (hôpital Robert Debré AP-HP, coordinatrice du centre de référence constitutif des maladies respiratoires rares – RespiRare) a présenté les nouveaux résultats du programme hospitalier de recherche clinique RESPPEDHEM, dont l’objectif est d’évaluer l’incidence des CPTNI chez l’enfant (de 0 à 18 ans), de définir les différentes formes cliniques, et d’identifier les facteurs de risque dans le but de permettre un diagnostic plus précoce. Parmi les CPTNI, on distingue la bronchiolite oblitérante (BO), la pneumonie organisée (PO), la pneumopathie interstitielle (PID), et la maladie veino-occlusive pulmonaire (MVOP).
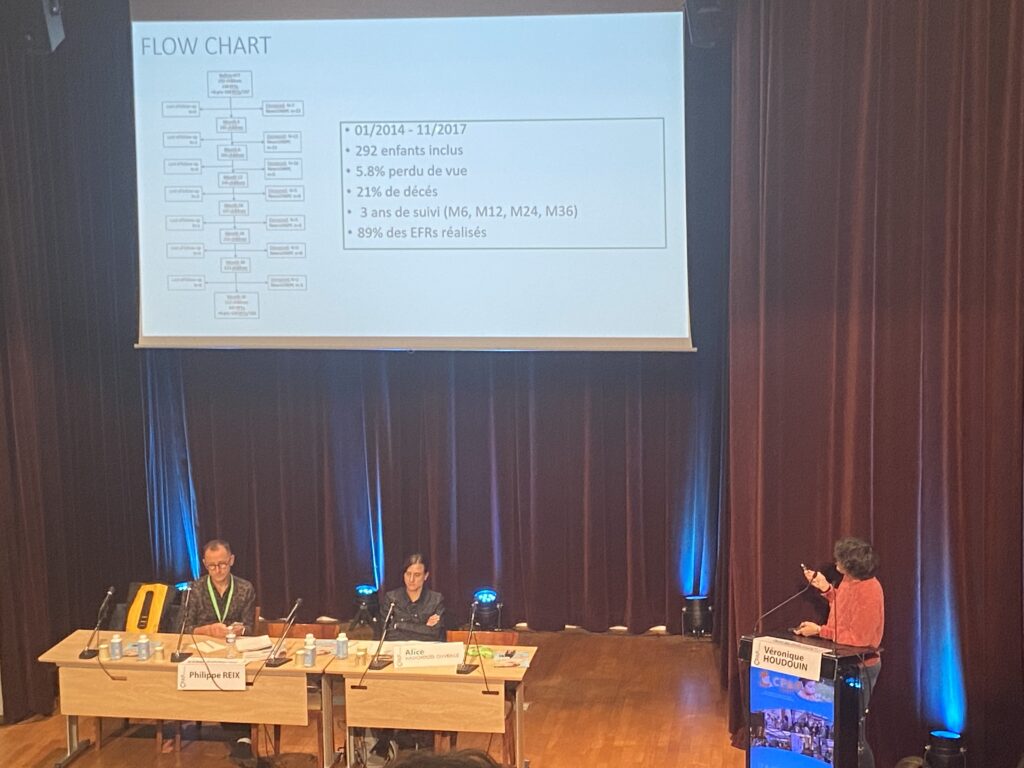
Résultats de l’étude RESPPEDHEM
L’étude, qui a inclus 292 enfants entre janvier 2014 et novembre 2017 dans 12 centres en France, a suivi ces jeunes patients pendant une période de 3 ans, avec des évaluations fonctionnelles respiratoires réalisées à 6, 12, 24, et 36 mois. Malheureusement, 5,8 % des enfants ont été perdus de vue et 21 % sont décédés au cours de cette période.
Les résultats révèlent une incidence des CPTNI de 11 %, la bronchiolite oblitérante (BO) se manifestant comme la complication la plus fréquente. Les symptômes respiratoires, tels que la toux et/ou la dyspnée, étaient présents chez la moitié des enfants lors du diagnostic, tandis qu’un tiers était asymptomatique. Intéressant à noter, 22 % des enfants ont présenté des infections respiratoires au cours des trois mois précédant le diagnostic de CPTNI. L’atteinte pulmonaire survenait très précocement, avec une médiane de 6,2 mois.


Concernant le traitement, celui-ci est variable incluant l’utilisation de corticothérapie orale et inhalée, cette dernière étant privilégiée pour la majorité des enfants, ainsi que l’azythromycine pour une proportion non négligeable.
Se penchant spécifiquement sur la bronchiolite oblitérante (BO), seulement 8 enfants remplissaient les critères du consensus du National Institutes of Health (NIH 2014) pour le diagnostic de BO à savoir :
- une diminution du VEMS < à 75% de la théorique ;
- la présence d’une obstruction des voies aériennes avec un VEMS/ CVF < 0,7 ;
- une élévation du volume résiduel VR > 120% de la théorique ;
Ainsi, il est à noter que la définition de la BO selon le NIH 2014 ne semble pas adaptée à la pédiatrie souligne le Pr Houdouin.
En conclusion, la BO demeure la complication la plus fréquente, parfois associée à une atteinte interstitielle ou une pneumonie organisée. Un tiers des enfants présentent une atteinte fonctionnelle non spécifique, et malgré une prise en charge, le test à l’effort demeure suboptimal à 3 ans en raison de l’atteinte musculaire. Ces découvertes soulignent l’importance d’une approche personnalisée et précoce dans le diagnostic et la prise en charge des CPTNI.


