Accès précoce et compassionnel aux médicaments : enjeux de cette réforme pour les patients et professionnels de santé

L’accès dérogatoire à des médicaments pour les patients en impasse thérapeutique est un engagement de longue date. Il a trouvé son fondement dans le domaine de l’oncologie et du VIH il y a plus de 25 ans.
En 2020, plus de 23 000 patients ont bénéficié d’une autorisation temporaire d’utilisation nominative et plus de 7000 patients pour des autorisations temporaires d’utilisation (ATU) de cohortes.
Cette refonte du système dérogatoire issue d’une collaboration conjointe de l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) et de la Haute Autorité de Santé (HAS) doit permettre un accès plus rapide à des médicaments innovants pour des patients en impasse thérapeutique qui ne peuvent pas rentrer dans des essais cliniques et pour lesquels le temps compte.
Ainsi, celle-ci assure la pérennité de l’accès compassionnel, enjeux majeur, tout en confortant l’accès à l’innovation.
Ce qui change au 1er juillet 2021
La Loi de Financement de la Sécurité Sociale (LFSS) pour 2021 pose, dans son article 78, les bases d’une réforme qui remplace le régime dérogatoire d’accès et de prise en charge des médicaments faisant l’objet d’autorisations temporaires d’utilisation (ATU) et de recommandations temporaires d’utilisation (RTU). Elle doit remplir les objectifs suivants :
- Accélérer, simplifier et harmoniser les procédures ;
- Renforcement de la collecte de données ;
- Garantir l’équité d’accès pour les patients ;
- Garantir la soutenabilité du modèle financier.
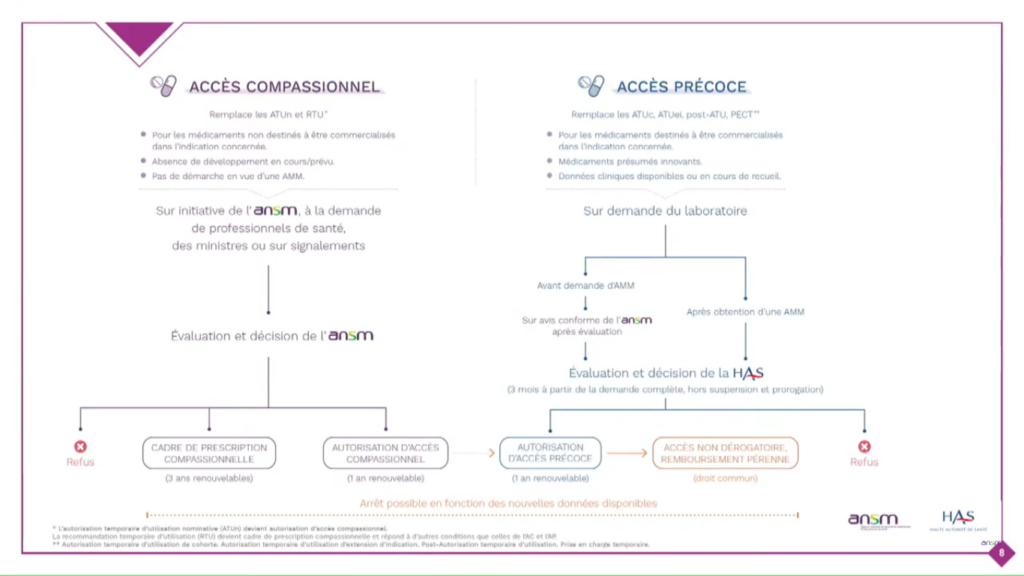
Pour ce faire, 2 nouveaux dispositifs sont entrés en vigueur au 1er juillet 2021 : l’accès précoce et l’accès compassionnel. Deux institutions ont co-construit, depuis bientôt 1 an, les outils et les documents qui vont faciliter le déploiement de ces dispositifs et ainsi permettre de renforcer l’accès aux traitements innovants. Il s’agit de l’Agence nationale de sécurité du médicament et des produit de santé (ANSM) et de la Haute Autorité de santé (HAS).
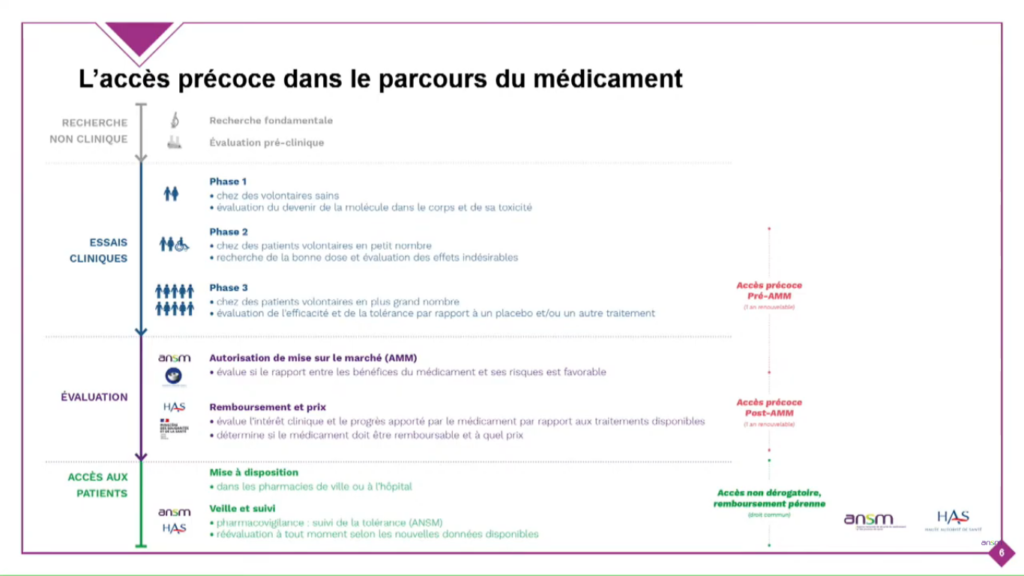
L’accès précoce : exemple d’utilisation temporaire d’utilisation de cohortes
Il vise les médicaments répondant à un besoin thérapeutique non couvert, susceptibles d’être innovants et pour lesquels les laboratoires pharmaceutiques s’engagent à déposer une autorisation de mise sur le marché (AMM) ou une demande de remboursement de droit commun.
Il ne vise pas à remplacer mais bien à compléter le dispositif des essais cliniques pour des produits ayant vocation à être commercialisés.
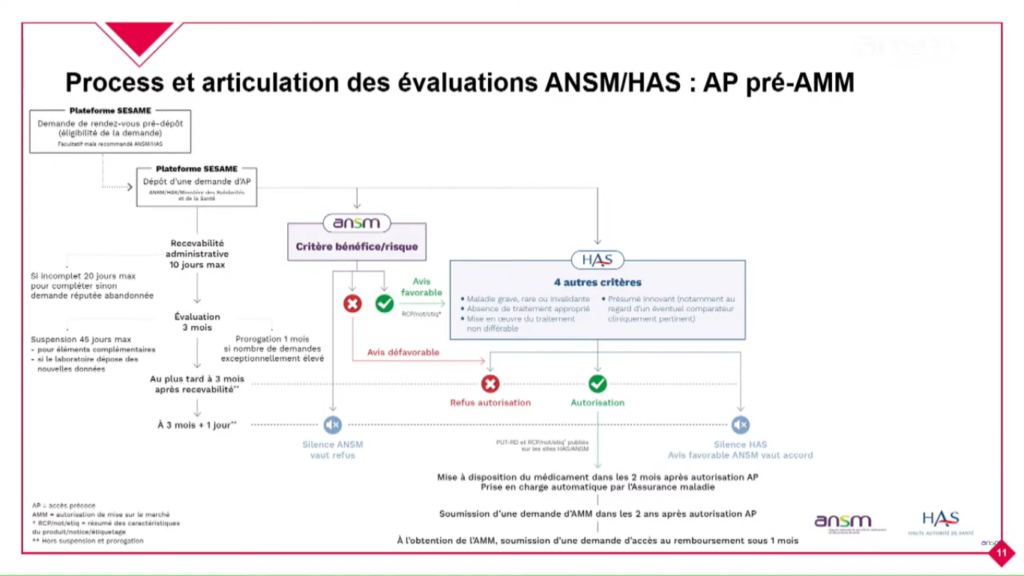
En pré Autorisation de Mise sur le Marché (AMM)
Évaluation par l’ANSM tout d’abord sur les aspects bénéfice / risque. A l’issue de la 1ère évaluation, si l’avis est favorable, la HAS évalue à son tour sur 4 critères transparents. Si l’évaluation de la HAS est positive, la prise en charge par l’Assurance Maladies est automatique et le médicament doit être mis à disposition par le laboratoire dans les 2 mois au maximum.

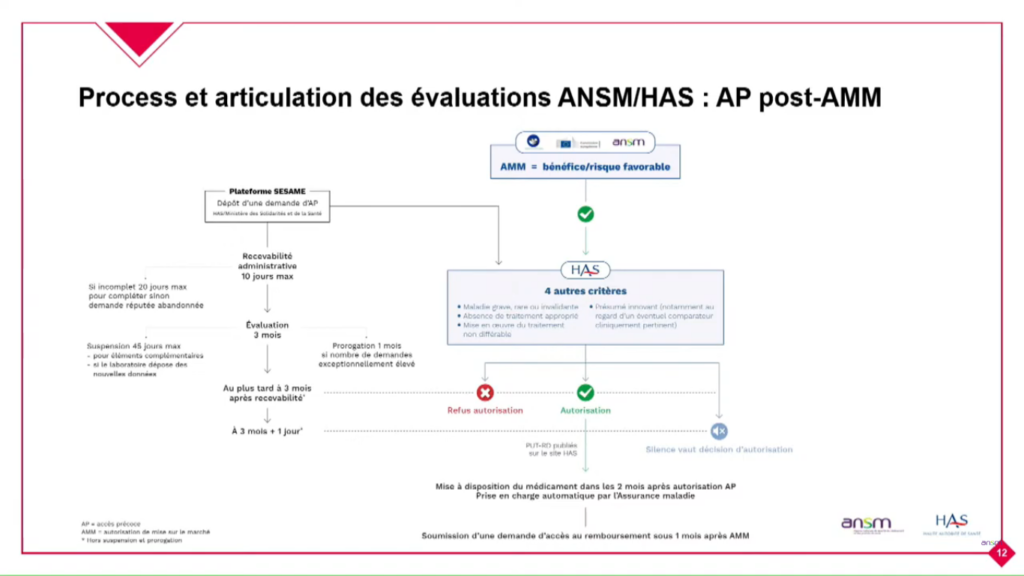
En post AMM
L’ANSM n’a pas de rôle direct de l’ANSM, seule la HAS réalise l’évaluation sur les mêmes critères que précédemment.
Une volonté forte de l’implication des patients dans ce nouveau dispositif qui pourront ainsi transmettre leur avis sur le traitement évalué, faire un retour d’expérience sur les traitements disponibles, attentes et craintes vis-à-vis du médicament, retour d’avis sur la gestion des risques en fonction du protocole de l’industriel. Pour ce faire un tableau sur le site de la HAS recense l’ensemble des médicaments avec leurs dates limites est à la disposition des patients, des informations à ce sujet via les réseaux sociaux de la HAS seront diffusées. De plus la HAS a assuré se mettre en relation avec les associations concernées.
Pendant l’utilisation du médicament en accès précoce, les patients pourrons également participer à la collecte des données en répondant aux Patients reporting outcome measures (PROMS) ou questionnaires de qualité de vie des patients.
L’accès compassionnel : exemple d’ATU nominatives et de Recommandations Temporaires d’Utilisation (RTU)
Il vise les médicaments non nécessairement innovants, qui ne sont initialement pas destinés à obtenir une AMM mais qui répondent de façon satisfaisante à un besoin thérapeutique non couvert. Ce sont des produits qui n’ont pas vocation à être commercialisés qui n’ont donc pas de recherche clinique dans une indication. L’évaluation se fait par l’ANSM. Lorsqu’elle est positive, la prise en charge par l’Assurance Maladie est automatique.


Et les maladies rares dans ces dispositifs ?
Le 3ème Plan National Maladies Rares (PNMR3), dans son 4ème axe – Promouvoir l’accès aux traitements dans les maladies rares – pages 23 à 26, définit 4 actions dont la création par les filières de santé maladies rares d’observatoires des traitements. La note de la Direction Générale de l’Offre de Soins du 20 mai 2021, indique que » la réussite de ce nouvel organe collaboratif repose sur l’implication de tous les acteurs et notamment sur la mobilisation des centres de référence et de compétence maladies rares ainsi que des centres de ressources et compétences, au sein de chaque filière de santé maladies rares (FSMR). » Elle fixe également le cadre de la création de l’observatoire pour chacune des FSMR.
RespiFIL débutera dès cet automne, et dans un premier, temps le recensement des pratiques de prescription hors AMM pour les pathologies de son périmètre en se référant aux PNDS déjà publiés, en sollicitant les experts de ses 87 centres labellisés ainsi que les associations de patients partenaires. Elle tâchera de rendre cet observatoire dynamique en assurant la veille et le recueil d’informations sur les traitements innovants tout au long de sa labellisation. Ainsi, elle concourra à la structuration et à la mise en œuvre des 2 nouveaux dispositifs introduits par la LFSS de 2021 grâce à l’implication de tous et aux liens étendus avec l’ANSM et plus largement la HAS afin de répondre aux spécificités des maladies rares prises en charge au sein de son réseau national.


