L’accès précoce à un médicament : le nouveau PUT-RD

L’accès précoce, c’est quoi ?
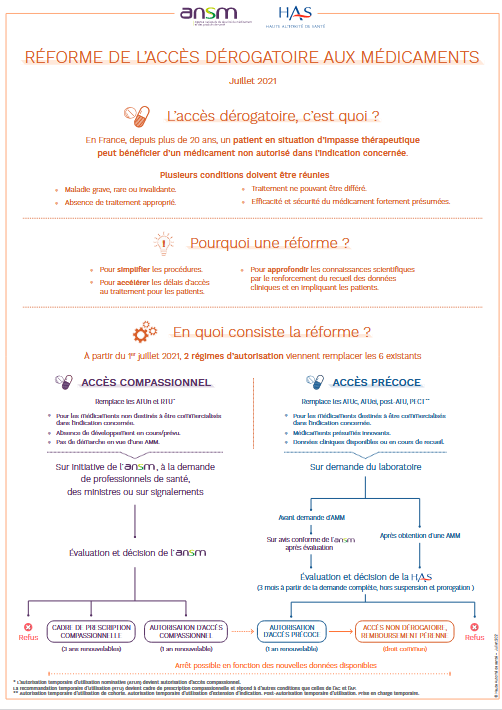
L’accès précoce est un dispositif qui permet aux patients atteints de maladies rares ou de pathologies graves pour lesquelles il n’existe pas d’autres traitements satisfaisants, d’accéder à titre exceptionnel et temporaire, à des médicaments non autorisés dans l’indication concernée.
Les conditions suivantes doivent être réunies :
- Maladie grave, rare ou invalidante
- Absence de traitement approprié
- Traitement ne pouvant être différé
- Efficacité et sécurité du médicament fortement présumées
L’accès précoce s’applique :
- Soit à un médicament qui dispose déjà d’une autorisation de mise sur le marché (AMM) dans l’indication considérée mais qui n’a pas encore été admis au remboursement par l’Assurance Maladie.
- Soit à un médicament qui ne dispose pas encore d’une AMM dans l’indication considérée et pour lequel le laboratoire pharmaceutique s’engage à déposer une demande. Dans ce cas, l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) doit émettre un avis conforme sur l’efficacité et la sécurité du médicament, en se basant sur les résultats des essais thérapeutiques, avant que la Haute Autorité de Santé (HAS) ne prenne sa décision.
L’autorisation d’accès précoce nécessite la collecte régulière de données par les prescripteurs et les patients sous la responsabilité du laboratoire pharmaceutique. Ces données doivent être transmises périodiquement à la HAS pour être évaluées. Cette évaluation est destinée à éclairer la décision des pouvoirs publics pour la prise en charge des produits de santé concernés par l’Assurance Maladie, ainsi qu’à déterminer les conditions de leur bon usage, leur place dans la stratégie de prévention, de diagnostic ou thérapeutique, et leur efficience en vue de la négociation de leur prix.
Nouveauté : PUT-RD à partir de BaMaRa
Dans le cadre du Plan National Maladies Rares 3 (PNMR 3), un recueil de données spécifique aux médicaments (données d’utilisation, d’efficacité et de tolérance) a été développé au sein de BaMaRa, l’application web de la Banque Nationale de Données Maladies Rares (BNDMR). Ce recueil se base sur un set de données minimum pour les traitements (SDM-T) unique pour toutes les maladies rares et permettant le suivi et l’évaluation d’un médicament aussi bien dans le cadre des accès précoces ou compassionnels que pour des études post-inscription.
Il est le fruit d’une concertation nationale incluant l’ANSM, la HAS, la Direction Générale de l’Offre de Soins (DGOS), les Filières de Santé Maladies Rares (FSMR) ainsi que les industriels du médicament et leurs partenaires.
Pour la collecte de données via BaMaRa dans le cadre des accès précoces, le SDM-T se décline sous la forme d’un modèle adapté de protocole d’utilisation thérapeutique et de recueil des données (PUT-RD) propre à BaMaRa, qui est très proche du modèle de PUT-RD « classique » et co-rédigé par la HAS, l’ANSM et la cellule opérationnelle de la BNDMR.
L’utilisation de ce modèle adapté de protocole d’utilisation thérapeutique et de recueil des données (PUT-RD) par les industriels permet d’assurer une certaine cohérence dans la façon dont les données sont recueillies, ce qui facilite les comparaisons entre les différentes études menées pour un même médicament.
Interventions orales : journée annuelle RespiFIL
Le mardi 26/09 prochain, la filière consacrera lors de sa journée annuelle, une session aux observatoires dont l’observatoire du traitement et nous aurons le plaisir d’accueillir l’ANSM qui interviendra sur « Bilan et évolutions des accès dérogatoires » ainsi que Bénédicte SABIN, cheffe de Projet Epidémiologiste à la BNDMR, qui abordera « Accès compassionnel/précoce/SDM-T ». N’hésitez pas à vous inscrire pour en apprendre davantage et échanger avec elles.
Information patient
Vous êtes sous traitement dans le cadre d’un accès précoce ? L’équipe médicale qui vous suit doit présenter une demande au laboratoire pharmaceutique. Lors de l’instauration du traitement et tout au long de celui-ci, un recueil de données sera mis en place et vous pourrez être interrogé.
Les notes d’information patient BaMaRa et BNDMR intègrent la possibilité de recueillir des données dans le cadre d’études portant sur le médicament.